Capture the activity of thousands of communicating neurons all at once
(何千もの交信する神経細胞を一瞬で捕捉)
Nature Communicationsに公開された最新の神経チップ
本日(2020年9月25日)、Nature Communicationsに新世代の高密度微小電極アレイ(HD-MEA)が掲載されました。 この研究は、チップの優れた性能を見せるだけでなく、軸索伝導速度など神経マトリックスのラージスケールな抽出、およびさまざまな神経系サンプルに対するアプリケーションも印象的です。 ラベルフリーで生細胞電気イメージングのためのこの多用途なプラットフォームは、神経科学の分野で創薬と基礎研究をさらに加速します。


微小電極アレイ上の神経細胞 ユアン・シンユエ, BEL, ETH チューリッヒより提供
これは、スイス連邦工科大学チューリッヒ校(以下ETHチューリッヒ)Bio Electronics Laboratory(以下BEL)のアンドレアス・ヒルマン教授の下で行われたユアン・シンユエ(袁心月)の博士論文研究の集大成です。 この研究には弊社CEOのウルス・フレイ博士とヒルマン教授が共同で指導にあたりました。 今年5月に彼女は無事に論文審査を通過しました。
さまざまな世代の微小電極アレイ(MEA)を15年以上開発してきたヒルマン教授の研究室は、この研究分野では常に最先端を歩み続けてきました。ヒルマン教授は次のように説明しています。「新しいチップは、細胞内区画から個々の神経細胞、ネットワーク全体に至るまで、非常に短時間で神経細胞と神経細胞網をスケール全体で研究する可能性を飛躍的に高めます。これは、初代神経細胞や、健康な状態および病気の状態のヒトiPS細胞または神経細胞組織片または神経組織のスライスに適用され、薬物スクリーニングに特に有効です。」
新しいデバイスの特徴は、一般的に最も使用される2つの読み出し方式を組み合わせた全く新しい「デュアルモード」回路設計を備えていることです。それはETHチューリッヒでウルスが先駆けて開発した「スイッチマトリックス」の概念、そしてHD-MEAでは一般的に見られる「フルフレーム」読み出し(これらのコンセプトの長所と短所は、以前ウルスがイニシアチブをとった神戸の理化学研究所の研究ユニットでマリー・オビエンらのレビュー記事で説明されています)。簡単に言えば、スイッチマトリックスは、チャネル数を減らして、可能な限り低ノイズでニューロン信号を記録することを可能にします。一方、「フルフレーム」設計は、信号品質と空間分解能に妥協しますが、チャネル数を増やし、実験時間を短縮できます。全く新しいデュアルモードの概念により、両方の長所を1つのデバイス内で活用できるため、実験がより効率的になります。デュアルモードアプローチにより、システムは数多くの生物学的アプリケーションの要件に対して非常に用途が広くなります。
ハイライト
- 3050電極/ ㎟の空間分解能で19,584電極
- 10.4 Vrmsで11.6 kFrames / sで同時にすべての電極のフルフレーム読み出し
- 3.0 Vrmsで24.4 kSamples / sの246チャネルの設定可能なサブセットのスイッチマトリックス読み出し
- 1000以上の個々のニューロンから軸索側枝の長さや伝導速度などの形態電気的特徴を提供する軸索信号を抽出および追跡するための新しいアルゴリズム
- 2次元培養された初代神経細胞とヒトiPS細胞由来神経細胞に対するアプリケーション紹介。海馬および小脳からの急性脳スライス; 3次元iPS細胞由来の神経スフェロイド; 急性網膜標本; およびスキャフォールドで培養されたiPS細胞由来の神経細胞
デュアルモードプロジェクト: チップデザインからアプリケーション


実験に使用できるデュアルモードチップ。 ユアン・シンユエ、BEL、ETH チューリッヒ提供
デュアルモードチップの開発中に経験したことについてシンユエに聞いてみました。 「私はプロジェクトのどの分野もとても楽しかったです。IC(集積回路)の設計分野はとても面白かったです。設計中に考慮すべきことがたくさんあり、私が望むパフォーマンスを得るためにパラメータを調整することは楽しかったです」と、シンユエは笑顔で答えてくれました。
シンユエは、チップの設計の他に、それを使って実験も行いました。 「私にとって生物学的実験も興味深いものでした。私は電気技師なので、生体サンプルを扱う際、初めてのことばかりでした。実験中にチップをセットし、画面に信号がきちんと表示されたときは、非常に満足して興奮しましたた。異なったサンプルの違った活動パターンから、神経細胞の記録から信頼に足る結論を導き出すには、いかに高品質の信号を取得することが重要であるかがよく分かりました。より成熟したシステムでは容易に結果が得られることは一般的かもしれませんが、私が習得したようなプロトタイプシステムでは、すべてのステップがきちんと機能し、良好な信号を取得できるようにするために、より多くの研究と忍耐が必要でした」と彼女は説明しました。
シンユエは全体を通して次のように述べています。「ICの設計とシステムを機能させるだけでなく、多岐に渡る実験を試みて、様々な神経細胞の標本への適用性を実証するなど、全てのプロジェクトを完遂できたことを誇りに思っています。これまで不可能だった、何千もの神経細胞を抽出し長期間にわたって追跡することは、満足のいく成果でした。」
もちろん、全てのプロジェクトと同様、彼女にもいくつかの難題がありました。 「このプロジェクトで最も困難な箇所は、システムのデュアルモード機能を最大限に活用するための適切なアプリケーションを見つけることです。それぞれのモードには、アプリケーション毎に独自の利点があります。プロジェクト中、私たちは研究室の同僚から素晴らしいサポートを受け、ヒトiPS細胞由来神経細胞を記録するためにデュアルモードを使用するというアイデアが浮かんだんです。これらの細胞の振幅信号は非常に低く、軸索の追跡にはスイッチマトリックスの感度が要求されます。さらに、数千のニューロンの抽出を並列化するために、フルフレームの記録が必要です。これはデュアルモード操作と完全に一致し、iPS細胞研究の発展に向けたデュアルモードMEAの将来的な貢献を楽しみにしています」と話してくれました。
起源:なぜデュアルモードなのか?
弊社CEOのウルスに、このプロジェクトの裏側を少し話してもらいました。
「2005年頃に行った私のPhD研究において、この分野への貢献の一つとして言えるものが、HD-MEAのためのスイッチマトリックス概念の先駆けでした。基本的に、当時、私たちの研究室は既にフルフレーム概念を使用した機能的なMEAシステムを設計していましたが、電極密度がわずか16電極/ ㎟であり、用途は非常に限られていました。そのため、スイッチマトリックスの概念に挑戦し、電極密度を3000電極/ ㎟以上に高めました。このことはシステムのような適用範囲を劇的に広げました。最終的に、それこそたくさんの電極を介して、単一神経細胞のニューロンフットプリントと呼ばれるものを抽出することができました。」スイッチマトリックスは、スパイクソーティングと新しい細胞下の特徴の抽出の改善も促進しました(このストーリーの詳細については、ETHZニュース記事をお読みください)。
ウルスは続けます。「 ヒルマン教授の研究室は、今までに無いより大きなアレイへとスイッチマトリックス概念の限界に挑戦し、より多くのチャネルと新しい読み出し様式へとつながりました。その成果の一つがMaxOneおよびMaxTwo製品ラインで使用されているコアセンサーチップです。MEAを使用して良好な結果を得るには、3000電極/ ㎟を超える高い空間分解能と十分に低ノイズレベルが核であると確信しています。」


Eヒルマン教授の研究室におけるHD-MEAの進化。ヒルマン教授の研究室、ETHチューリッヒ提供
ウルスは2011年に日本に移りました。理研生命システム研究センターで彼の研究室を開設し、デュアルモードについての最初のディスカッションはそこで行われました。 「ひとつのシステムにフルフレームとスイッチマトリックス両方の読み出し機能を組み込んだシステムの構築を検討し始めたのは、2012年の神戸にある前のバイオエレクトロニクス研究室でした。両方の利点を組み合わせると、全てのアプリケーションに適用する究極のHD-MEAが出来上がるためです」とUrsは振り返ります。 「当初、私は非常に懐疑的でした。また、スイッチマトリックス概念のパイオニアとなり、「フルフレーム」の世界に踏み込むことに少し恐怖を感じていたことを認めざるを得ません。当時のポスドクが私にその領域に入ることを納得させるのに、相当苦労したと思います。また、2つの異なる読み出しを1つのシステムに組み合わせることは非常に困難でした。特に、空間分解能について妥協したくなかったので、複雑な回路を各センサーピクセルで利用できる小さな領域に詰め込む必要がありました。日本の私の研究室で修士課程を修了したシンユエと、当時のポスドクであったキム・スンホ博士と共著者とで、2016年に完全に機能するデュアルモードMEAシステムを発表したときは達成感がありました。」最初の達成感を味わいつつ、まだまだ改善の余地がありました。 「実際にシステムをさまざまなアプリケーションに適用できるようにするには、大幅な再設計が必要でした。これは、今発表されたばかりのHD-MEAで実現しました。電極とチャネルの数を2倍にしながら、高い電極密度を維持し、ノイズ、サンプリングレート、電力消費をさらに改善しました。」
それはまだトンネルの終わりではありませんでしたが、それでも測定を行う必要があり、さまざまなアプリケーションを備えたシステムの用途が広いことを示しました。


2015年後半、ヒルマン教授と共に研究ユニットを指揮するウルス。左から Alexandra Dudina, Prof. Hierlemann, Xinyue Yuan, Urs Frey, Marie Obien, Stefan Huber, Michele D’Urbino, Tomoko Kamatani, Florent Seichepine.
現場でのシステムパフォーマンスの紹介
初代神経細胞、急性網膜、急性小脳スライス、ヒトiPS細胞由来の心筋細胞などのサンプルを含む、BELで行われた記録とは別に、システムの多様性を実証するための幅広いアプリケーションを紹介したいと思いました。ウルスがその時はまだ「楽観的なアイデア」でしかなかった方法(ほとんどの人には「非現実的なアイデア」と言われた)を私に話して来たことを思い出します。計画そのものは、様々なデバイス、ケーブル、コンピューター、壊れやすいカスタムメイドのセットアップなどを入れた、なんともかさばるシステム(2つの1㎥の箱を想像してください)を、概念実証研究を行うために日本の協力者に出荷することでした。わかりました、大陸間を行き来して、複数の試験と数回の渡航が必要になるとは想像もしませんでしたが。目の回るような忙しさでしたが、MaxWell Biosystemsの物流部門を立ち上げ、日本の販売代理店である株式会社フィジオテックの協力の下、計画は無事に達成されました。システムと私たちは長い旅を乗り切りました。


デュアルモードチップ上の神経細胞スフェロイド。画像は、CiRA京都大学の菊池哲宏博士と、BEL、ETHチューリッヒのシンユエ提供
デュアルモードシステムは、日本の2つの研究室に導入されました。 1つは、山中伸弥教授の研究所である京都大学iPS細胞研究所(CiRA)でした。臨床応用研究部門の高橋淳教授の研究室の助教である菊池哲弘博士と協力しました。「私たちの研究室では、再生医療のためにドーパミン作動性ニューロンなどのヒトiPS細胞由来神経細胞から生成した成熟した神経細胞スフェロイドを開発しています。これらのスフェロイドは、パーキンソン病などの神経変性疾患の治療法として、人間の脳に移植される可能性があります。そのようなスフェロイドは、なるべく自発的に活動し、健康な脳で観察されるものと同様の振動パターンを作成する必要があります。したがって、移植前に、神経細胞スフェロイドの活動を特徴付け、分離することなく、スフェロイドとしての機能を評価することが必要不可欠です。私たちは、デュアルモードHD-MEAに置いた複数の神経細胞スフェロイドからの電気的活動を見た時は興奮しました。感度とセンサー領域が大きいことは、私たちの神経細胞スフェロイドの機能を容易に評価して研究するために非常に望ましいことです」と菊池博士は説明してくれました。
デュアルモードシステムは、京都から東北工業大学の鈴木郁郎准教授の研究室にある仙台に移動しました。鈴木先生は、日本におけるヒトiPS細胞応用安全性評価コンソーシアム(CSAHi)のMEAに基づくアッセイ開発のアドバイザーです。鈴木先生はデュアルモードシステムの結果に非常に満足されました。「私たちの研究室では、ヒトiPSニューロンとマウスの急性脳スライスにおける電気生理学的活動に基づいた薬理および毒性評価方法を開発しています。アッセイ開発における経験と微小電極アレイ(MEA)の広範囲の使用により、化合物の効果と異なる細胞株間の差異を効果的に検出するためには、感度と単一細胞の解像度が重要であることがわかりました。新しいデュアルモード高密度MEAを使用したとき、捕捉できたデータの質に感銘を受けました。」
動画: 急性海馬スライスの局所フィールド電位伝播。画像は、東北工業大学の鈴木郁郎准教授とETHチューリッヒ、BEL 、ユアン・シンユエ提供
「たとえば、私たちは急性脳スライスを使用して、生体外で痙攣をモデル化しています。 2×4㎟内で20,000電極を同時に記録できたため、様々な領域にわたって高解像度で急性海馬スライスの化学的に誘発された局所フィールド電位の開始と伝播を初めて見ることができました。また、SCADデバイスで培養されたヒトiPS細胞由来神経細胞の軸索に沿って伝播する個々の活動電位を観察できました。iPS細胞由来の神経細胞は、通常、初代細胞と比較して信号が小さいため、これは非常に印象的です」と鈴木先生は述べています。
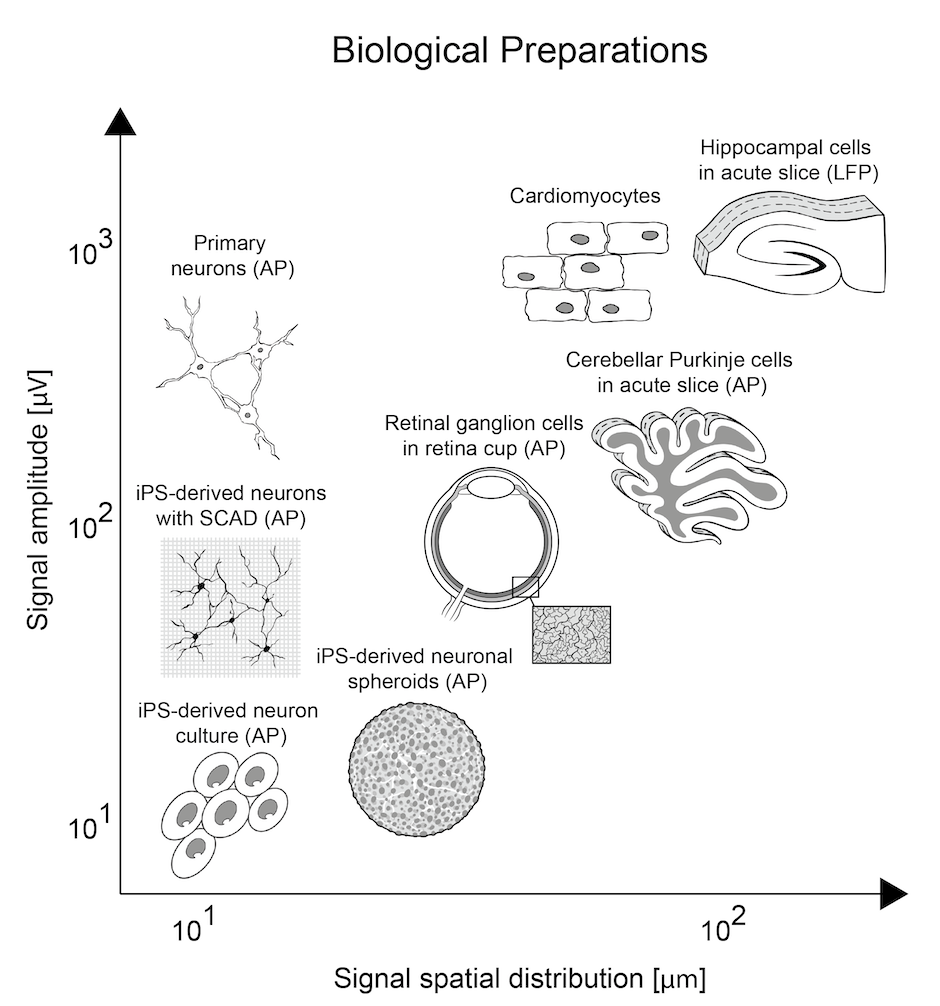

デュアルモードシステムで行われる様々なアプリケーション
唯一のデュアルモードシステムがバーゼル(スイス )に戻ったとき、シンユエの使命はまだ達成されていませんでした。1番の課題は、大量のデータを処理するためのアルゴリズムを開発することでした。 それから彼女は、取得した全てのデータを分析し、印象的な一連の図、動画、統計グラフを作成しました。 「データ分析、特にたくさんの神経細胞から軸索追跡を行うことも楽しかったです。それは単純なアルゴリズムの問題のように見えましたが、自動化するためには少し立ち止まって作業する必要がありました。私にとってさらに満足のいく瞬間は、アレイ全体を網羅する神経細胞のフットプリントを備えた良く見える神経細胞を見つけたときでした。」とシンユエは言います。ネットワーク接続を分析するために、シンユエはBELのポスドクであるManuel Schröterのサポートも仰ぎました。
動画: 培養中の神経細胞の軸索側枝に沿って伝播する活動電位。提供: ユアン・シンユエ、BEL、ETHチューリッヒ。
動画: 細胞内で交信する神経細胞。提供:ユアン・シンユエ、 BEL、ETH Zurich.
「シンユエがどのようにして以下を抽出するアルゴリズムを実践したかに感銘を受けました。振幅、発火率、軸索伝導速度、軸索の長さ、軸索分岐、ネットワークバースト機能、ネットワーク接続、これらの大規模なデータセットを上手く実行し、生データの美しい動画を制作しました」とウルスは誇らしげに笑います。 「オタクっぽく聞こえるかもしれませんが、このシステムで録画された動画を見たとき、何度も何度も見続けました。生データを単一の活動電位解像度で、このような広い領域で交信している全ての個々の神経細胞を見られることに、私は今だに驚きを隠せません。得られたデータは、フルフレームの読み出しが効率を大幅に向上させる一方で、iPS細胞由来神経細胞でよく見られるような低振幅の信号は、非常に低いノイズの記録を必要とし、それはこのシステムのスイッチマトリックスモードでのみ可能であることを最終的に示していました。したがって、デュアルモードシステムと組み合わせることで、システムは多くのアプリケーションで万能になるのです」とウルスは締めくくりました。
引用
Yuan, X., Schröter, M., Obien, M.E.J., Fiscella, M., Gong, W., Kikuchi, T., Odawara, A., Noji, S., Suzuki, I., Takahashi, J., Hierlemann, A., and Frey, U. Versatile live-cell activity analysis platform for characterization of neuronal dynamics at single-cell and network level. Nat Commun 11, 4854 (2020). https://doi.org/10.1038/s41467-020-18620-4
MaxWell Biosystems AGは、現在このシステムの商品化を検討しています。 現時点では予約注文は受け付けておりませんが、ご興味がおありの方は、マリー(marie.obien@mxwbio.com)までご連絡ください。
 日本語
日本語


